مقالات
فلوسایتومتری چیست؟
فلوسایتومتری روشی برای سنجش سلول ها یا ذرات می باشد که در جریان مایع از طریق لیزر یا پرتو نور شناسایی میشوند و پراکندگی نسبی نور و رنگ فلورسانس متمایز ذرات اندازه گیری می شود.
تجزیه و تحلیل و تمایز سلول ها بر اساس اندازه و گرانولاریتی و اینکه آیا سلول حامل مولکول های فلورسنت ( به صورت آنتی بادی یا رنگ) است، میباشد. فلوسایتومتری به طور کلی برای تجزیه و تحلیل سلول های منفرد در یک سوسپانسیون استفاده می شود و در ایمونولوژی و هماتوپاتولوژی رایج است. ویژگی های فلوسیتومتری عبارتند از: سرعت تجزیه و تحلیل، حساسیت تشخیص، توانایی اندازه گیری پارامترهای متعدد به طور همزمان، و توانایی جداسازی سلول ها.
اصول فلوسایتومتری
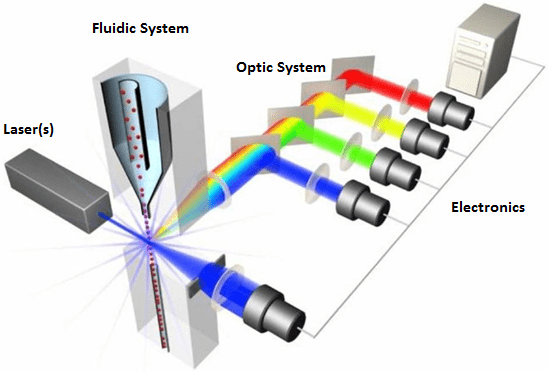
فلوسیتومتری مدرن از یک منبع نور، سیستم جمع آوری نوری (اپتیک)، سیستم الکترونیک و یک کامپیوتر برای تبدیل سیگنال ها به داده ها تشکیل شده است و در یک فایل داده با فرمت استاندارد (fcs.) ذخیره میشوند. منبع نور انتخابی لیزری است که نور منسجمی را در طول موج مشخصی ساطع می کند. نور فلورسنت پراکنده و ساطع شده توسط دو عدسی جمع آوری می شود، یکی در جلوی منبع نور (Forward scatter) و دیگری در زوایای قائم (Side scatter) توسط یک سری اپتیک تقسیم کننده پرتوها و فیلترها، باندهای فلورسانس خاص می توانند اندازه گیری شوند. اکثر سایتومترها می توانند سلول هایی با قطر بین 1 تا 15 میکرون را تشخیص دهند، اگرچه امکان تشخیص ذرات خارج از این محدوده (150-0.2 میکرون) با استفاده از سیستم های تخصصی وجود دارد.
تجزیه و تحلیل فلوسایتومتری با حرکت هزاران سلول (در هر ثانیه) از طریق پرتو لیزر و سپس گرفتن نوری که پس از هر عبور ظاهر می شود، انجام می شود. نرم افزار تخصصی، داده های جمع آوری شده را برای کشف ویژگی های سلولی مانند اندازه، پیچیدگی داخلی، فنوتایپ و سلامت سلول ها تجزیه و تحلیل می کنند. این قابلیت یعنی اندازه گیری چندین پارامتر از ده ها هزار سلول منفرد در عرض چند دقیقه قدرت واقعی فلوسایتومتری است.
چندین نوع لیزر موجود است که می توانند در فلوسایتومترها استفاده شوند. آنها می توانند لیزرهای گازی (به عنوان مثال هلیوم-نئون، آرگون، هلیوم-کادمیم) باشند. یا لیزرهای جامد (به عنوان مثال NdYAG)؛ لیزرهای رنگی یا لیزرهای نیمه هادی.
Fluidic system
محفظه جریان، به عنوان هسته فلوسایتومتر، ذرات (سلول ها و/یا میکروب ها) را به لیزر منتقل می کند. نقطه بازجویی (interrogation point) که در آن لیزر با نمونه تلاقی می کند، همچنین مکانی است که سیستم اپتیک پراکندگی نور و فلورسانس را تشخیص می دهد. سیستم سیال یک فلوسایتومتر برای رساندن سلول ها در یک جریان منفرد و منظم به نقطه بازجویی طراحی شده است به طوری که در هر زمان فقط یک سلول از طریق فرآیندی به نام تمرکز هیدرودینامیکی از آن عبور کند.
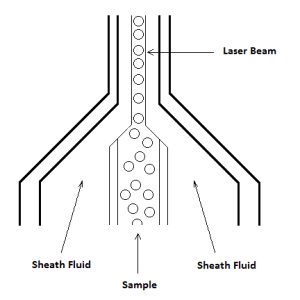
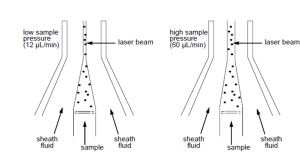
نمونه به مرکز جریانی از مایع غلافی تزریق می شود. فشار نمونه همیشه بیشتر از فشار سیال غلافی است. سرعت جریان نمونه با تنظیم فشار نمونه نسبت به فشار غلافی با استفاده از یک تنظیم کننده فشار ، کنترل می شود. سرعت جریان با افزایش فشار نمونه افزایش می یابد، که هسته نمونه را پهن می کند به طوری که سلول های بیشتری در یک زمان از نقطه بازجویی عبور می کنند. برعکس، کاهش فشار نمونه، سرعت جریان را با فشرده کردن هسته نمونه کاهش میدهد، در نتیجه سلولهای کمتری در یک زمان از پرتو لیزر عبور میکنند (شکل ۳). یک هسته نمونه وسیعتر میتواند منجر به عبور برخی سلولها از لیزر شود که کمی خارج از مرکز هستند و بنابراین پرتو را با زاویه کمتر از بهینه قطع میکنند. به طور کلی، نرخ جریان بالاتر به معنای وضوح پایین تر است و بهترین استفاده برای اندازه گیری های کیفی (به عنوان مثال، ایمونوفنوتایپ) است. سرعت جریان کمتر منجر به وضوح بیشتر می شود، زیرا بیشتر سلول ها از مرکز لیزر عبور می کنند و معمولاً در تست هایی استفاده می شوند که وضوح بالاتر بسیار مهم است (مانند تجزیه و تحلیل DNA).
Lasers
تمرکز هیدرودینامیکی ذرات و سلولها را تراز میکند تا قبل از رسیدن به نقطه بازجویی، یک ذره را از هسته نمونه عبور دهند. در آن نقطه، نور در همه جهات شکست یا پراکنده می شود. میزان انحراف نور تا حد زیادی به ویژگی های فیزیکی یک ذره، به ویژه پیچیدگی و اندازه داخلی آن بستگی دارد. شکل سلول، توپوگرافی سطح، غشاء، هسته و گرانولاریتی بر پراکندگی نور تأثیر میگذارند.
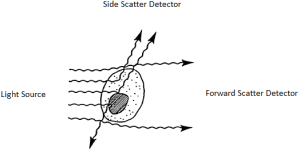
پراکندگی نور در دو زاویه جمع آوری می شود: پراکندگی رو به جلو (FSC) و پراکندگی جانبی (SSC). پراکندگی رو به جلو اندازه گیری نور عمدتاً پراش شده در جهت مسیر لیزر یا جهت رو به جلو است و متناسب با مساحت یا اندازه سلول است. پراکندگی جانبی تقریباً در 90 درجه از مسیر لیزر جمع آوری میشود و متناسب با پیچیدگی داخل سلولی میباشد(شکل ۴).
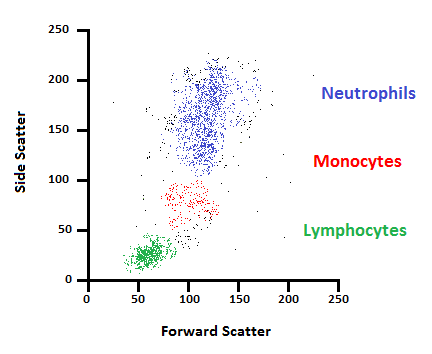
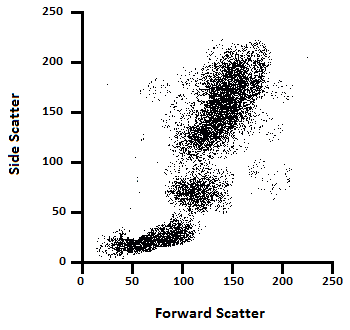
دادههای Forward scatter و Side scatter را میتوان برای طبقهبندی نمونهها بر اساس اندازه (FSC) و بر اساس پیچیدگی داخلی (SSC) استفاده کرد. به عنوان مثال، شکل 5 نشان می دهد که چگونه ترسیم داده های پراکندگی رو به جلو در برابر داده های پراکندگی جانبی می تواند اطلاعات مورفولوژیکی را در مورد یک نمونه خون محیطی نشان دهد (هر نقطه نشان دهنده یک سلول است). دادههای FSC رسم شده روی محور X امکان تمایز اندازه را با لنفوسیتهای کوچکتری که در سمت چپ ظاهر میشوند، میسازد، در حالی که دادههای SSC (محور y) تمایز بین مونوسیتها و نوتروفیلهای با اندازه مشابه را بر اساس گرانولاریتی سلول ممکن میسازد. فلوسایتومترها همچنین قادر به تشخیص فلورسانس از سلول های دارای برچسب مناسب هستند. ترکیب دادههای FSC، SSC و فلورسانس به محققان این امکان را میدهد تا زیرجمعیتهای متعدد سلولها را از نمونههایشان شناسایی کنند.
لیزر یون آرگون، که نور ۴۸۸ نانومتری ساطع می کند، بیشتر در فلوسایتومتری استفاده می شود، زیرا می تواند چندین فلوروکروم را تحریک کند. اگر هر کدام در یک طول موج (در این مورد، ۴۸۸ نانومتر) برانگیخته شده باشند و طول موجهای انتشار اوج آنها خیلی به هم نزدیک نباشند، میتوان از فلوئوروکرومهای مختلف به صورت ترکیبی استفاده کرد.
دو تا از پرکاربردترین فلوروکروم هایی که این معیارها را برآورده می کنند فلورسین ایزوتیوسیانات (FITC) و فیکواریترین (PE) هستند. طیف جذب FITC و PE تقریباً 495 نانومتر است و به راحتی توسط طول موج 488 نانومتر لیزر آرگون تحریک میشود (توجه : PE دارای حداکثر جذب مضاعف است و در 545 نانومتر نیز به حداکثر می رسد). طول موج اوج انتشار FITC و PE (به ترتیب 530 نانومتر و 570 نانومتر) به اندازه کافی دور هستند به طوری که سیگنال های آنها را می توان توسط آشکارسازهای مختلف دریافت کرد. انتخاب فلوئوروکروم مورد استفاده هم تحت تأثیر کاربرد ، هم طول موج های تحریک و در دسترس بودن لیزر مناسب است.
جدول زیر فلوئوروکروم های اصلی را فهرست میکند که توسط پرکاربردترین لیزر یون آرگون ۴۸۸ نانومتری و طول موجهای انتشار همراه با کاربردهای رایج آنها برانگیخته میشوند. اندازهگیری ویژگیهای فیزیکی مانند اندازه، شکل و تخلخل داخل سلولی و هر جزء یا عملکرد سلولی که توسط یک ترکیب فلورسنت قابل تشخیص باشد، قابل تجزیه و تحلیل است. انواع معرف های فلورسنت در فلوسایتومتری مورد استفاده قرار می گیرند که شامل آنتیبادیهای کونژوگه با فلورسنت، رنگ های اتصال به DNA، رنگ های زندهمانی، رنگهای شاخص یونی و پروتئینهای بیان فلورسنت هستند.
سیگنال های فلورسانس قوی، وجود تعداد زیادی مولکول فلوئوروکروم روی یک سلول/ذره را نشان می دهد. هنگامی که یک ترکیب فلورسنت مانند فلورسین ایزوتیوسیانات یا فیکواریترین به یک آنتی بادی مونوکلونال کونژوگه می شود، می توان از آن برای شناسایی انواع سلول های خاص به دلیل پروتئین های سطحی منفرد استفاده کرد که مشخصه آن سلول تمایز یافته است. بنابراین، در یک نمونه ترکیبی از سلولها، میتوان از فلوئوروکرومهای مختلف برای حذف زیرجمعیتهای جداگانه استفاده کرد. همراه با دادههای FSC و SSC، رنگآمیزی فلورسانس هر زیرجمعیت به تعیین نوع و چند درصد سلول در نمونه کمک میکند.
اندازهگیری فلوسایتومتری با دو و سه رنگ رایجترین روش میباشد، با این حال پیشرفتهای جدید در سختافزار (لیزرها و اپتیک)، فلوئوروکرومها، و ابزارهای تحلیل نرمافزاری امکان اندازهگیریهای چند رنگ (۵ یا بیشتر) را فراهم میکنند.
سه کلید برای فلوسایتومتری چند رنگ وجود دارد:
- فلوئوروکروم با شدت فلورسانس بالا، به راحتی با آنتی بادی های مونوکلونال کونژوگه شده و با همپوشانی طیفی کمی بین یکدیگر.
- لیزرهای متعدد برای تحریک رنگ های مختلف و فیلترهای انتخابی برای محدود کردن همپوشانی طول موج بین آشکارسازها.
- نرم افزار تجزیه و تحلیل قادر به جبران همپوشانی طیفی بین رنگ ها.
Optics
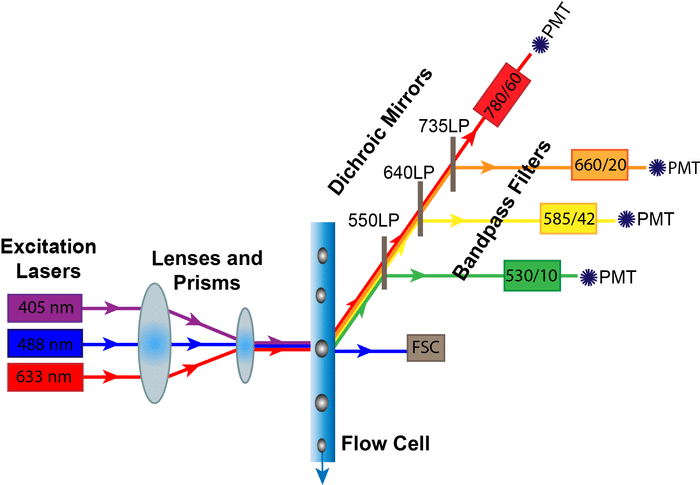
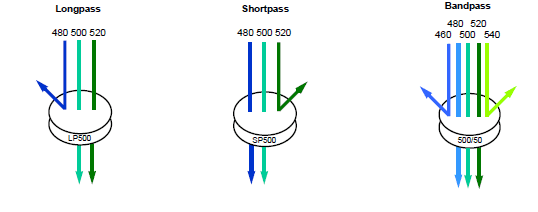
سیستم نوری فلوسیتومتری شامل دو بخش اپتیک تحریک (excitation optics) و اپتیک جمع آوری (collection optics) است. اپتیک های تحریک (لیزرها و لنزها) پرتو لیزر را متمرکز و شکل می دهند به طوری که به طور مداوم با نقطه بازجویی در یک موقعیت ثابت قطع می شود. نور ساطع شده از ذره با یک عدسی (عدسی جمعآوری) جمعآوری میشود و از طریق سیستمی از آینههای نوری (دو رنگ) و فیلترها (bandpass, shortpass, longpass) عبور میکند که طول موجهای مشخص شده نور را به آشکارسازهای نوری تعیینشده تغییر مسیر میدهند. این فرآیند توسط سیستم اپتیک به دست می آید.
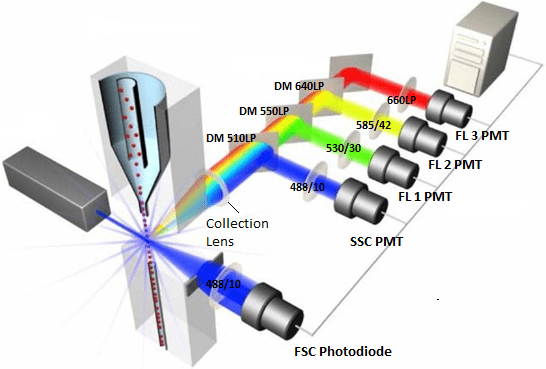
شکل ۶ مسیری را که پرتو لیزر پس از برخورد با ذره یا سلول طی می کند را نشان می دهد. نوری که در امتداد مسیر لیزر در جهت جلو (FSC) حرکت می کند توسط یک لنز جمع آوری شده و به یک فتودیود فرستاده می شود که سیگنال نور را به جریان تبدیل می کند که به نوبه خود توسط سیستم الکترونیکی ثبت می شود. همانطور که در بالا ذکر شد، این نور سیگنال پراکندگی رو به جلو است و متناسب با اندازه سلول است. نور نیز با زاویه 90 درجه نسبت به مسیر لیزر جمع آوری می شود. این نور نشان دهنده سیگنال پراکندگی جانبی و همچنین هرگونه انتشار فلورسنت از فلوروکروم های برانگیخته است. SSC ساطع شده و نور فلورسانس توسط یک عدسی جمع آوری شده و به آشکارسازهایی به نام لوله های مولتی پلایر نوری (PMT) هدایت می شود. سیگنال های نور از طریق یک سری آینه های دو رنگ (DM) و فیلترهای نوری به آشکارسازهای خود هدایت می شوند.
از آنجایی که PMT ها اغلب سیگنال های فلورسنت ضعیف را تشخیص می دهند، فیلترهایی در مقابل آنها قرار می گیرند تا توانایی آنها را برای تشخیص رنگ تعیین شده نور خود بهینه کنند. این فیلترها فقط به گونه ای ساخته شده اند که به طیف باریکی از طول موج ها اجازه عبور داده و مطابق با پیک انتشار رنگ های فلورسنت مورد استفاده باشد. فیلترهایی که اجازه عبور باند طیفی خاصی از نور را می دهند، فیلترهای باند گذر (BP) نامیده می شوند. به عنوان مثال، فیلتری که در جلوی آشکارساز FITC قرار داده شده است دارای برچسب 530/30 است، به این معنی که تنها نور با طول موج 515 نانومتر تا 545 نانومتر قادر به عبور خواهد بود.
از انواع دیگر فیلترها در فلوسیتومتری استفاده می شود. فیلترهای گذر کوتاه (SP) طول موج های نور را برابر یا کوتاهتر از یک طول موج مشخص ارسال می کنند و فیلترهای گذر طولانی (LP) طول موج هایی مساوی یا بیشتر از یک طول موج تعریف شده را می دهند (شکل 7).
به طور خلاصه، لیزر(ها) و عدسی های متمرکز اپتیک تحریک کننده پرتوی از نور تولید می کنند که با ذره یا سلول ها در نقطه بازجویی ثابت برخورد می کند. پراکندگی نور تولید شده از این برهمکنش سلول-لیزر توسط لنزهای جمع آوری شده و به یک فتودیود (FSC) هدایت می شود یا از طریق سیستمی از آینه ها و فیلترها (SSC و فلورسانس ساطع شده) به ردیاب های نوری مناسب (PMTs) هدایت می شود. آشکارسازها سیگنال های نور را به جریان تبدیل می کنند که سپس به سیستم الکترونیکی ارسال می شود.
Electronics
عملکرد سیستم الکترونیکی فلوسایتومتر دوگانه است. تبدیل سیگنال های نور به سیگنال های الکترونیکی (ولتاژ) و انجام تجزیه و تحلیل داده ها. اولی توسط یکی از دو نوع آشکارساز نوری که در بالا ذکر شد (فتودیودها و لامپ های مولتیپلیر نور) به دست می آید. فتودیود حساسیت کمتری به نور دارد و در درجه اول برای تشخیص سیگنال پراکندگی رو به جلو قوی تر استفاده می شود. PMT ها قادر به شناسایی سیگنال های بسیار ضعیف تری هستند و بنابراین برای تشخیص پراکندگی جانبی ساطع شده و نور فلورسانس استفاده می شوند.
یک سیگنال الکترونیکی یا پالس ولتاژ زمانی ایجاد می شود که یک ذره/سلول وارد مسیر پرتو لیزر می شود و شروع به پراکندگی نور یا فلورسانس می کند. سپس این نور وارد ردیاب های نوری (PMT یا فوتودیود) شده و به الکترون تبدیل می شود. الکترون ها بیشتر و بیشتر می شوند و جریان الکتریکی بزرگتری ایجاد می کنند. سپس جریان تقویت شده و به یک پالس ولتاژ تبدیل می شود. با ورود سلول به مسیر لیزر، پالس ولتاژ شروع به افزایش میکند، زمانی که در مرکز پرتو قرار میگیرد به اوج میرسد و پس از عبور کامل از آن به حالت اولیه باز میگردد (شکل 8).
Analysis
یکی از مزایای عمده فلوسایتومتری این است که محقق را قادر می سازد تا چندین ویژگی فیزیکی هر سلول را در یک جمعیت نمونه اندازه گیری کند. پس از جمع آوری داده ها و انتقال به فرمت دیجیتال، با استفاده از نرم افزار کامپیوتری سایتومتر آماده تجزیه و تحلیل می باشد. عمق تجزیه و تحلیل تکمیل شده بر روی داده ها تا حد زیادی توسط اهداف محقق تعیین می شود و می تواند از طبقه بندی مورفولوژی ساده یک نمونه با ترسیم FSC و SSC تا شناسایی زیرجمعیت های متعدد (از طریق gating) در یک نمونه با استفاده از نشانگرهای مختلف سطح سلول (فلوئوروکروم) متفاوت باشد.
رایجترین روشهای تجسم دادههای فلوسیتومتری در زیر مورد بحث قرار گرفتهاند.
هیستوگرام ها و نمودارهای پراکندگی (Scatter Plots)
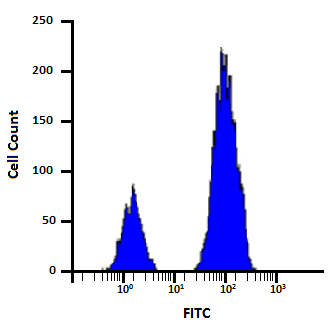
هیستوگرام یک نمودار تک پارامتری است که در آن محور y تعداد رویدادها (تعداد سلول ها) و محور x (log یا linear) پارامترهای مقدار سیگنال دیجیتال را نشان می دهد. به عنوان مثال، شکل 9 یک هیستوگرام با مقیاس لگاریتمی را نشان می دهد که در آن محور افقی شدت سیگنال FITC و محور عمودی تعداد رویدادها در هر کانال را نشان می دهد.
Gating
زیر مجموعه داده ها را می توان از طریق gating تعریف کرد. gating یک مرز عددی یا گرافیکی است که برای جداسازی زیرجمعیتهای ذرات/سلولها به منظور تولید آمار در مورد تعداد محدودی از رویدادها در یک نمونه معین استفاده میشود.
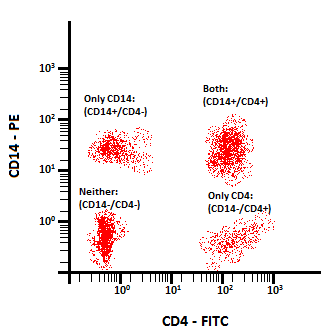
برای مثال، اگر محققی نمونهای از خون محیطی را که با فلوئوروکروم رنگآمیزی شده بود برای شناسایی پروتئینهای سطحی CD4 و CD14 تجزیه و تحلیل میکرد، اما فقط به دانستن درصد مونوسیتهای حاوی آن نشانگرها علاقه داشته باشد، ممکن است gate را در اطراف جمعیت مونوسیت FSC در مقابل SSC (شکل 11) قرار دهد.
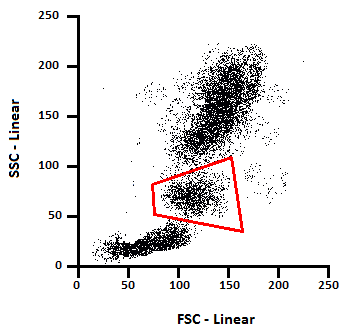
در نتیجه داده هایی را که آنها تجسم می کنند به مونوسیت ها در مقایسه با کل جمعیت سلول ها محدود می کند. در مرحله بعد، با استفاده از gating، آنها میتوانند درک واضحتری از اینکه چند درصد از مونوسیتها فقط CD4، فقط CD14، چند درصد هیچکدام یا هر دو را بیان کنند، داشته باشند (شکل 12)
Sorting
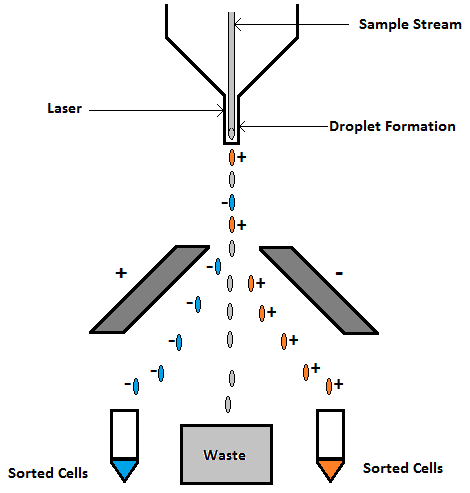
پس از عبور یک ذره/سلول از پرتو لیزر به یک آسپیراتور زباله فرستاده می شود. مرتبسازی سلولهای فعال شده با فلورسانس (FACS) فرآیندی است که در آن سلولهایی که از یک فلوسایتومتر عبور کردهاند را میتوان گرفت و برای تجزیه و تحلیل بیشتر (به عنوان مثال، میکروسکوپ، کشت سلولی و غیره) جمعآوری کرد.
برای مرتبسازی سلولها، ابتدا باید gate در اطراف جمعیت مورد نظر در حین خوانش قرار داده شود، بنابراین سایتومتر مطمئن میشود که کدام سلولها را از نمونه جدا کند. با اعمال gate مرتب سازی، نرم افزار اکنون قادر است سلول های زیرجمعیت مورد نظر را که متعاقباً از لیزر عبور می کنند، شناسایی کند. با استفاده از یک مایع غلافی رسانا، جریان نمونه هنگام خروج از نازل ارتعاش مییابد که باعث میشود به قطرات با اندازه ثابت (هر کدام حاوی یک سلول) تجزیه شود. سپس یک بار به قطره های حاوی سلول هایی اعمال می شود که معیارهای تعیین شده با gate را برآورده می کنند. در دو طرف جریان ارتعاشی صفحات دارای بار مثبت و منفی قرار دارند. همانطور که قطرات باردار از کنار این صفحات عبور می کنند، بسته به قطبیت بار قطرات، به ظروف جمع آوری منحرف می شوند (شکل 13). مرتب سازی سلولی به طور قابل توجهی پتانسیل تحقیقاتی و تشخیصی فلوسایتومتری را گسترش داده است، زیرا این امکان را فراهم می کند که زیرجمعیت های ذرات/سلول ها از نمونه های ناهمگن با درجه خلوص بالا جدا شوند.
سازندگان فلوسایتومتر نرم افزاری را برای راه اندازی دستگاه های خود ارائه می دهند. این برنامه ها عمدتاً برای راه اندازی برنامه ها و جمع آوری داده ها استفاده می شوند. به عنوان مثال، Becton، Dickinson و Company شامل یک کپی از BD FACSDiva با سایتومترهای خود هستند، برای مثال [26]. این نرم افزار تنظیم سایتومتر را برای ساده کردن عملیات به صورت خودکار انجام می دهد. همچنین یک رابط تجربی بصری برای جمع آوری داده های راحت و قابل تکرار در اختیار کاربر قرار می دهد. علاوه بر این، با استفاده از نرم افزار FACSDiva، کاربران سایتومتر می توانند اپتیک داخلی دستگاه را با استفاده از یک ابزار بصری که طرح آشکارسازها، فیلترها و آینه ها را نشان می دهد، پیکربندی کنند. نرم افزار ارائه شده توسط سازنده نیز می تواند برای تجزیه و تحلیل داده ها استفاده شود. با این حال، قابلیتهای آنها اغلب تنها به عملکردهای اساسی محدود میشود.
نرمافزاری با قابلیت تجزیه و تحلیل کامل برای کاربران سایتومتر در دسترس است که به سطح بالاتری از تجزیه و تحلیل نیاز دارند که برنامههای سازنده دستگاه قادر به ارائه آن نیستند. FlowJo یکی از محبوب ترین بسته های نرم افزاری برای تجزیه و تحلیل داده های فلوسیتومتری در بازار است. سایتومترها فایل های داده را در قالب فلوسایتومتر استاندارد (پسوند فایل .fcs) می نویسند. برنامه های شخص ثالث مانند FlowJo این فایل های داده را وارد می کنند تا تجزیه و تحلیل بدون در نظر گرفتن مارک فلوسایتومتر برای جمع آوری امکان پذیر باشد.
خلاصه
فلوسیتومتری از اصول پراکندگی نور و تحریک و انتشار مولکول های فلورسنت برای جمع آوری داده های چندپارامتری از سلول ها و ذرات با اندازه های ۰.۲ تا ۱۵۰ میکرون استفاده می کند. بزرگترین نقطه قوت فلوسایتومتری سرعت آن است. با استفاده از یک هموسایتومتر بر روی یک میکروسکوپ مرحله ای، یک دانشمند می تواند تقریباً ۲۵۰ سلول را در یک دقیقه بشمارد اما یک فلوسایتومتر می تواند هزاران سلول را در چند ثانیه تشخیص دهد.
Flow cell جایی است که نمونه ها به صورت هیدرودینامیکی در یک جریان فایل واحد از ذرات/سلول ها متمرکز می شوند. در نقطه بازجویی، سلولها از یک پرتو لیزر عبور میکنند که باعث میشود نور آن (و هر فلوئوروکروم موجود) در همه جهات پراکنده شود. مجموعه لنزها در موقعیت جلو و جانبی (90 درجه) این نور پراکنده را به سمت یک سیستم سخت افزاری نوری هدایت می کند. شبکهای از تقسیمکنندههای پرتو (آینهها) و فیلترها، طول موجهای خاصی از نور را به ردیابهای نوری مربوطه (فتودیود و PMT) تغییر مسیر میدهند، جایی که سیگنال تقویت شده و به جریان الکتریکی تبدیل میشود.
سپس این پالس ولتاژ توسط یک سیستم کامپیوتری به یک سیگنال دیجیتال تبدیل می شود. نرم افزار تجزیه و تحلیل برای طبقه بندی و دسته بندی سلول ها بر اساس خواص پراکندگی نور آنها استفاده می شود. جمعیت های فرعی را می توان با استفاده از گیت ها و هر تعداد گزینه ترسیم از جمله هیستوگرام ها و نمودارهای نقطه ای بررسی کرد. برای نگهداری یا خالصسازی نمونهها، تجهیزات مرتبسازی که سلولها را پس از عبور از لیزر بازیابی و جمعآوری میکند در دسترس است.
فلوسایتومتری یک روش برتر برای تجزیه و تحلیل سلولی است، اما قیمت بالایی دارد. بزرگترین نقطه ضعف استفاده از فلوسایتومتری عدم مقرون به صرفه بودن است (دوم، اندازه است). سیتومترها ماشین های حجیمی هستند که از سی هزار (کارکرده) تا ششصد هزار دلار (نو) متغیر هستند، بدون احتساب هزینه سیال غلاف، فلوئوروکروم ها، قطعات جایگزین، نرم افزار آنالیز و سایر تجهیزات مورد نیاز برای اجرای آنها. بسیاری از موسسات دانشگاهی و بیمارستانها تعداد انگشت شماری از ماشینها را بین تمام بخشهای خود به اشتراک میگذارند تا هزینه خرید و نگهداری یک سایتومتر را جذب کنند و از این طریق آنها را در اختیار هرچه بیشتر محققین قرار دهند.
فناوری فلوسیتومتری در حال پیشرفت است. در نتیجه هزینه ها کاهش می یابد. لیزرهای دیودی جدیدتر و ارزانتر جایگزین لیزرهای یون گاز بسیار گرانتر میشوند . همچنین، دستگاههای ارزانتری با استفاده از اصول فلوسیتومتری در حال توسعه هستند. در سال 2011، گروهی از محققان در UCLA یک سایتومتر سبک وزن و فشرده را طراحی و مهندسی کردند که به تلفن همراه متصل می شود و هزینه کارکرد آن کمتر از ده دلار است. با وجود هزینه های بالا و نیاز به اپراتورهای آموزش دیده، فلوسایتومتری همچنان اولین و بهترین انتخاب برای تجزیه و تحلیل نمونه با سرعت بالا است.
نویسنده: پوریا غیایی